突破增生性瘢痕机制!CILP1-YBX1-PPARs 通路解锁诊断新靶点与治疗新思路
2025/10/23
增生性瘢痕(HS)是皮肤创伤愈合过度的产物,不仅会导致外观畸形,还常伴随瘙痒、疼痛甚至功能障碍,给患者生活质量带来严重影响。目前,临床针对增生性瘢痕的治疗手段(如手术、激光、药物注射等)均存在复发率高、副作用明显等局限,其核心症结在于瘢痕形成的分子调控机制尚未完全阐明。
今天和大家分享一篇关于聚焦增生性瘢痕发病机制研究的文章,该文章于2025年5月发表在Cell Death Dis杂志上,标题为“CILP1 interacting with YBX1 promotes hypertrophic scar formation by suppressing PPARs transcription”。
![]()
01. 研究思路
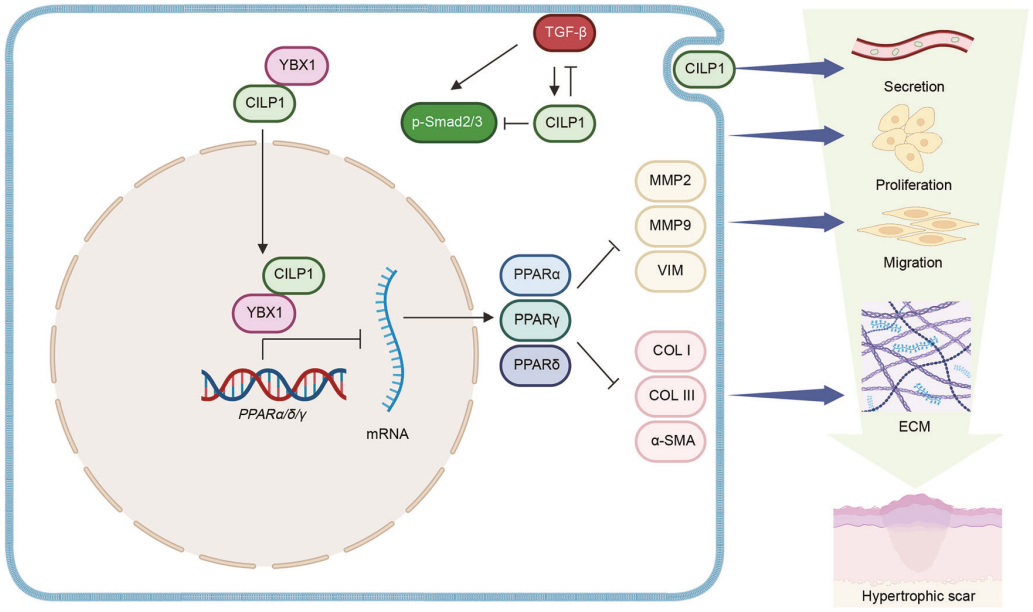
本文围绕“CILP1在增生性瘢痕(HS)形成中的作用及机制”展开研究。首先通过RNA测序从人HS组织中筛选出差异基因CILP1,结合qRT-PCR、Western blot、ELISA验证其在人HS / 瘢痕疙瘩组织、HS患者血清及3种HS动物模型中均高表达,免疫荧光定位其主要来源于肌成纤维细胞。其次,采用siRNA敲降、过表达转染、重组蛋白刺激,结合CCK-8、EdU、划痕 / Transwell、胶原收缩实验,证实CILP1促进HS 成纤维细胞增殖、迁移及胶原合成。进而通过GSEA锁定PPARs通路,经Co-IP + 质谱筛选出互作蛋白YBX1,利用分子对接、GST pull-down验证直接结合,核质分离、NLS突变明确CILP1介导YBX1核转运,再以ChIP-qPCR、双荧光素酶实验证实YBX1 结合PPARs启动子抑制其转录,同时通过TGF-β1刺激与抑制剂干预揭示二者负反馈关系。最后,通过AAV2体内敲降和重组蛋白注射,结合组织染色、免疫组化,在HS 小鼠模型中验证CILP1促瘢痕作用,最终阐明“CILP1-YBX1-PPARs”调控机制,为HS诊断(血清标志物)与治疗提供靶点。
02. 主要研究内容
(1)CILP1与TGF-β通路在增生性瘢痕成纤维细胞(HSFs)中形成负反馈环路
为探究CILP1与TGF-β通路的关系,研究以TGF-β1处理的成纤维细胞模型为基础,通过系列技术验证二者调控机制:采用Western blot和ELISA检测发现,重组人 TGF-β1以浓度依赖方式上调 HSFs中CILP1的表达及分泌;经siRNA敲降TGF-β1后,胞内及胞外CILP1水平降低但未完全消失;结合蛋白合成抑制剂环己酰亚胺(CHX)实验证实,TGF-β1通过增强CILP1蛋白稳定性实现上调。免疫荧光染色显示 TGF-β1可刺激HSFs中α-SMA表达,提示CILP1可能参与成纤维细胞 - 肌成纤维细胞转化。进一步通过siRNA 敲降 CILP1,发现其可减弱TGF-β1对HSFs增殖、迁移及ECM合成的促进作用;而CILP1过表达质粒转染能逆转si-TGF-β1诱导的α-SMA、COL I、COL III下调。此外,Western blot检测显示CILP1敲降会升高TGF-β1 和p-Smad2/3水平、降低p-ERK1/2水平;联合使用TGF-β1特异性抑制剂(SB431542)与CILP1敲降,通过CCK-8、Transwell、Western blot等技术证实对 HSFs功能的抑制效果增强。
![]()
(2)CILP1在增生性瘢痕成纤维细胞(HSFs)中抑制PPARs通路
为明确CILP1的下游机制,研究首先通过RNA测序(RNA-seq) 检测CILP1敲降组与对照组的差异基因,经基因集富集分析(GSEA)锁定PPARs信号通路为核心关联通路,并发现CILP1敲降显著上调PPARα、PPARδ等通路关键基因表达。随后利用qRT-PCR和Western blot 验证:敲降CILP1可上调HSFs中PPARα、PPARδ、PPARγ 的mRNA及蛋白水平,过表达CILP1则呈相反效应;而重组人CILP1蛋白干预未影响 PPARs表达,提示胞内CILP1是主要调控形式。通过免疫组化检测人组织样本,证实 HS组织中PPARs蛋白水平显著低于正常皮肤。为验证通路必要性,采用PPARα抑制剂(GW6471)、PPARδ 抑制剂(GSK3787)、PPARγ 抑制剂(GW9662) 及泛抑制剂(Norathyriol) 处理HSFs,结合CCK-8、Transwell、Western blot 等技术发现:各抑制剂均能逆转CILP1敲降对HSFs增殖、迁移及ECM合成的抑制作用,且泛抑制剂效果优于单一抑制剂;双敲降CILP1与PPARs 也可挽救胶原及α-SMA的表达下调,进一步证实CILP1通过抑制PPARs通路发挥作用。
![]()
![]()
(3)CILP1 通过与 YBX1 相互作用在 HSFs 中抑制 PPARs 通路
SHAPE \* MERGEFORMAT 为探究CILP1抑制HSFs中PPARs通路的机制,研究先通过pull-down联合质谱(pull-down-MS) 筛选出112种CILP1潜在互作蛋白,锁定促纤维化转录因子YBX1 为核心候选;再经分子对接证实二者可通过氢键和盐桥形成稳定复合物,Co-IP验证内源性相互作用,GST pull-down确认体外直接结合。通过免疫荧光染色和核质分离实验发现CILP1与YBX1共定位且CILP1可促进YBX1核转运;利用在线工具预测CILP1核定位序列(NLS)并构建突变质粒,结合免疫荧光与Western blot证实野生型CILP1 通过NLS介导YBX1核转运,突变型则无此功能。后续通过qRT-PCR与Western blot发现YBX1敲降可上调PPARs表达;经JASPAR软件 预测YBX1在PPARs启动子上的结合基序,ChIP-qPCR(含 RNase A 预处理)证实YBX1直接结合启动子,双荧光素酶报告实验验证结合基序突变会破坏相互作用,明确YBX1转录抑制PPARs。最后通过联合敲降实验证实:YBX1敲降下调纤维化标志物,PPARs敲降则相反,双敲降可逆转表型,最终揭示CILP1通过与YBX1互作介导其核转运,进而抑制PPARs通路的机制。
![]()
03. 参考文献
Wang JZ, Du J, Song YJ, et al. CILP1 interacting with YBX1 promotes hypertrophic scar formation by suppressing PPARs transcription. Cell Death Dis. 2025, 16(1):371. doi: 10.1038/s41419-025-07554-8